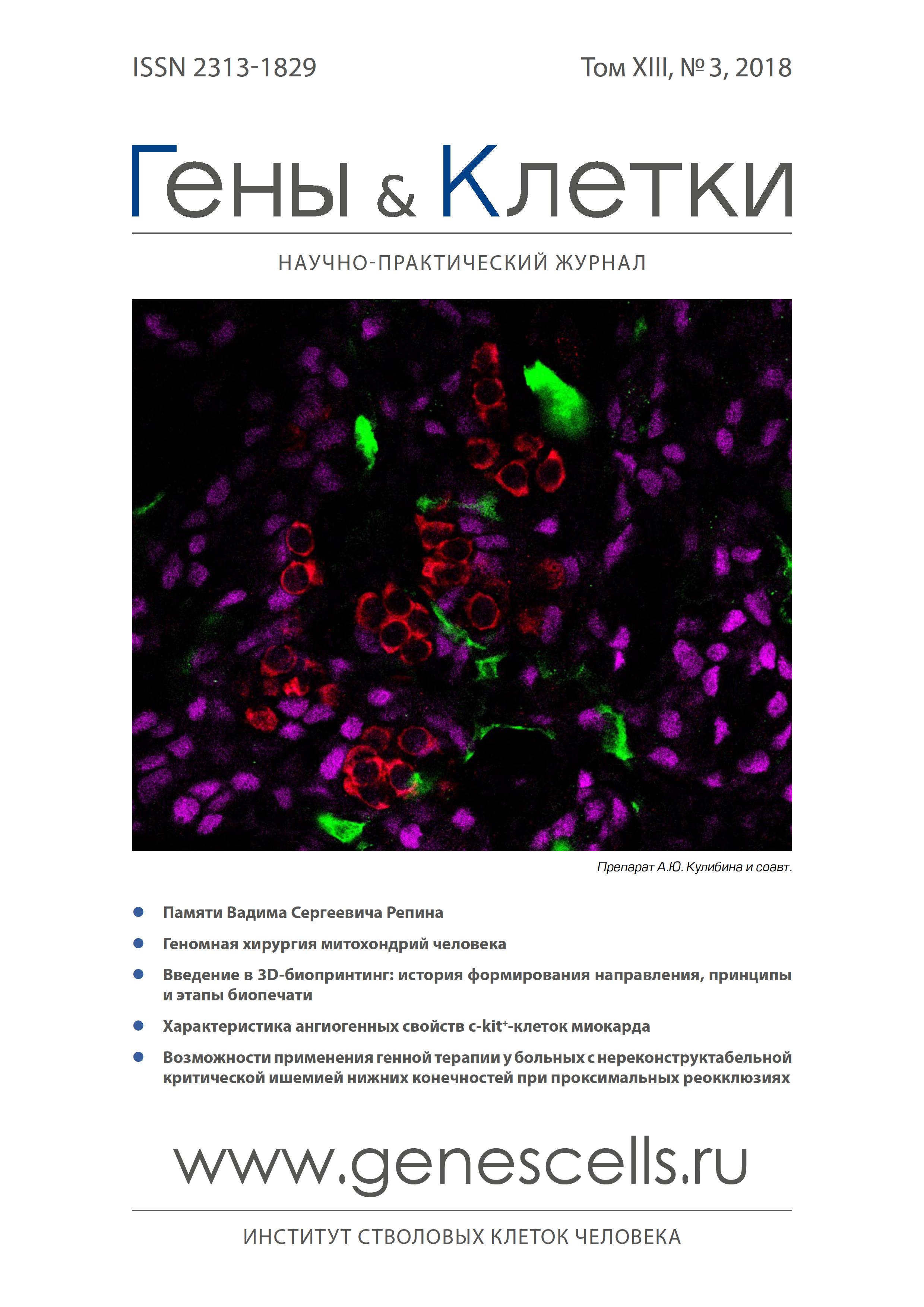
Характеристика ангиогенных свойств c-kit+-клеток миокарда
- Авторы: Дергилев К.В1, Цоколаева З.И1, Белоглазова И.Б1, Ратнер Е.И1, Молокотина Ю.D1, Парфенова Е.В1,2
-
Учреждения:
- Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии
- Московский государственный университет им. М.В. Ломоносова
- Выпуск: Том 13, № 3 (2018)
- Страницы: 82-88
- Раздел: Статьи
- Статья получена: 05.01.2023
- Статья опубликована: 15.09.2018
- URL: https://genescells.ru/2313-1829/article/view/120751
- DOI: https://doi.org/10.23868/201811038
- ID: 120751
Цитировать
Полный текст
Аннотация
Ключевые слова
Полный текст
Об авторах
К. В Дергилев
Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии
Email: doctorkote@gmail.com
З. И Цоколаева
Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии
И. Б Белоглазова
Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии
Е. И Ратнер
Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии
ЮД. D Молокотина
Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии
Е. В Парфенова
Институт экспериментальной кардиологии Национального медицинского исследовательского центра кардиологии; Московский государственный университет им. М.В. Ломоносова
Список литературы
- Michler R.E. The current status of stem cell therapy in ischemic heart disease. J. Card. Surg. 2018; 33(9): 520-31.
- Litwinowicz R., Kapelak B., Sadowski J. et al. The use of stem cells in ischemic heart disease treatment. Kardiochir. Torakochirurgia. Pol. 2018; 15(3): 196-9.
- Lalu M.M., Mazzarello S., Zlepnig J. et al. Safety and efficacy of adult stem cell therapy for acute myocardial infarction and ischemic heart failure (SafeCell Heart): a systematic review and meta-analysis. Stem Cells Transl. Med. 2018; 9999: 1-10.
- Bolli R., Chugh A.R., D'Amario D. et al. Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial. Lancet 2011; 378(9806): 1847-57.
- Dergilev K.V., Rubina K.A., Tsokolaeva Z.I. et al. Left ventricular heart aneurism - a new source of resident cardiac stem cells. Tsitologiia 2010; 52(11): 921-30.
- Broughton K.M., Wang B.J., Firouzi F. et al. Mechanisms of Cardiac Repair and Regeneration. Circ. Res. 2018; 122(8): 1151-63.
- Dergilev K.V., Rubina K.A., Parfenova E.V. Resident cardiac stem cells. Kardiologiia 2011; 51(4): 84-92.
- Menasché P. Cell therapy trials for heart regeneration - lessons learned and future directions. Nat. Rev. Cardiol. 2018; 15(11): 659-71.
- Senyo S.E., Steinhauser M.L., Pizzimenti C.L. et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature 2013; 493(7432): 433-6.
- Cahill T.J., Choudhury R.P., Riley P.R. Heart regeneration and repair after myocardial infarction: translational opportunities for novel therapeutics. Nature Reviews Drug Discovery 2017; 16: 699-717.
- Ovsepyan A.A., Panchenkov D.N., Prokhortchouk E.B. et al. Modeling myocardial infarction in mice: methodology, monitoring, pathomorphology. Acta Naturae 2011; 3(1): 107-15.
- Traktuev D.O., Tsokolaeva Z.I., Shevelev A.A. et al. Urokinase gene
- transfer augments angiogenesis in ischemic skeletal and myocardial muscle. Mol. Ther. 2007; 15(11): 1939-46.
- Dergilev K.V., Makarevich P.I., Tsokolaeva Z.I. et al. Comparison of cardiac stem cell sheets detached by Versene solution and from thermo-responsive dishes reveals similar properties of constructs. Tissue and Cell 2017; 49(1): 64-71.
- Salikova S.P., Bakhtiiarov R.Z. The role of structural changes of the endothelium and myocardium in the development of experimental heart failure. Morfologiia 2008; 134(5): 20-5.
- Torsney E., Xu Q. Resident vascular progenitor cells. J. Mol. Cell. Cardiol. 2011; 50(2): 304-11.
- Leri A., Rota M., Hosoda T. et al. Cardiac stem cell niches. Stem Cell Res. 2014; 13(3): 631-46.
- Gambini E., Pompilio G., Biondi A. et al. C-kit+ cardiac progenitors exhibit mesenchymal markers and preferential cardiovascular commitment. Cardiovasc. Res. 2011; 89(2): 362-73.
- Broughton K.M., Wang B.J., Firouzi F. et al. Mechanisms of Cardiac Repair and Regeneration. Circ. Res. 2018; 122(8): 1151-63.
- Kobayashi K., Maeda K., Takefuji M. et al. Dynamics of angiogenesis in ischemic areas of the infarcted heart. Sci. Rep. 2017; 7(1): 7156.
- He L., Huang X., Kanisicak O. et al. Preexisting endothelial cells mediate cardiac neovascularization after injury. J. Clin. Invest. 2017; 127(8): 2968-81.
- Li Y., He L., Huang X. et al. Genetic Lineage Tracing of Non-Myocyte Population by Dual Recombinases. Circulation 2018; 138(8): 793-805.
- Tillmanns J., Rota M., Hosoda T. et al. Formation of large coronary arteries by cardiac progenitor cells. PNAS USA 2008; 105(5): 1668-73.
- Bearzi C., Leri A., Lo Monaco F. et al. Identification of a coronary vascular progenitor cell in the human heart. PNAS USA 2009; 106(37): 15885-90.
- Chen Z., Zhu W., Bender I. et al. Pathologic Stimulus Determines Lineage Commitment of Cardiac C-kit+ Cells. Circulation 2017; 136(24): 2359-72.
- Laurenzana A., Fibbi G., Margheri F. et al. Endothelial Progenitor Cells in Sprouting Angiogenesis: Proteases Pave the Way. Curr. Mol. Med. 2015; 15(7): 606-20.
- Tkachuk V.A., Plekhanova O.S., Parfyonova Y.V. Regulation of arterial remodeling and angiogenesis by urokinase-type plasminogen activator. Can. J. Physiol. Pharmacol. 2009; 87(4): 231-51.
- Loscalzo J. The macrophage and fibrinolysis. Semin. Thromb. Hemost. 1996; 22(6): 503-6.
- Stepanova V.V., Tkachuk V.A. Urokinase as a multidomain protein and polyfunctional cell regulator. Biochemistry (Mosc.) 2002; 67(1): 109-18.
- Parfenova E.V., Plekhanova V.V., Stepanova V.V. et al. Plasminogen activator of urokinase-type: mechanisms of involvement in vessel remodeling and angiogenesis, gene therapy approaches to ischemia. Ross. Fiziol. Zh. Im. I.M. Sechenova. 2004; 90(5): 547-68.
- Wu B., Zhang Z., Lui W. et al. Endocardial cells form the coronary arteries by angiogenesis through myocardial-endocardial VEGF signaling. Cell 2012; 151(5): 1083-96.
- Jin Z.G., Ueba H., Tanimoto T. et al. Ligand independent activation of vascular endothelial growth factor receptor 2 by fluid shear stress regulates activation of endothelial nitric oxide synthase. Circ. Res. 2003; 93: 354-63.
- Дергилев К.В., Цоколаева З.И., Белоглазова И.Б. и др. Интрамио-кардиальное введение c-kit+-прогениторных клеток сердца вызывает активацию прогениторных клеток эпикарда и стимулирует васкуляризацию после инфаркта. Гены и Клетки 2018; 13(1): 75-81.
- Chimenti I., Smith R.R., Li T.S. et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ. Res. 2010; 106: 971-80.
- Bianconi V., Sahebkar A., Kovanen P. et al. Endothelial and cardiac progenitor cells for cardiovascular repair: A controversial paradigm in cell therapy. Pharmacol. Ther. 2018; 181: 156-68.
- Barile L., Lionetti V., Cervio E. et al. Extracellular vesicles from human cardiac progenitor cells inhibit cardiomyocyte apoptosis and improve cardiac function after myocardial infarction. Cardiovasc. Res. 2014; 103(4): 530-41.
Дополнительные файлы