Растворимые факторы, образуемые при заживлении эндометрия, подавляют его «фиброзирование» in vitro
- Авторы: Еремичев Р.Ю1, Григорьева О.А1, Кулебякин К.Ю1, Ефименко А.Ю1, Макаревич П.И1
-
Учреждения:
- Институт регенеративной медицины, Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова
- Выпуск: Том 13, № 2 (2018)
- Страницы: 63-66
- Раздел: Статьи
- Статья получена: 05.01.2023
- Статья опубликована: 15.06.2018
- URL: https://genescells.ru/2313-1829/article/view/120738
- DOI: https://doi.org/10.23868/201808021
- ID: 120738
Цитировать
Полный текст
Аннотация
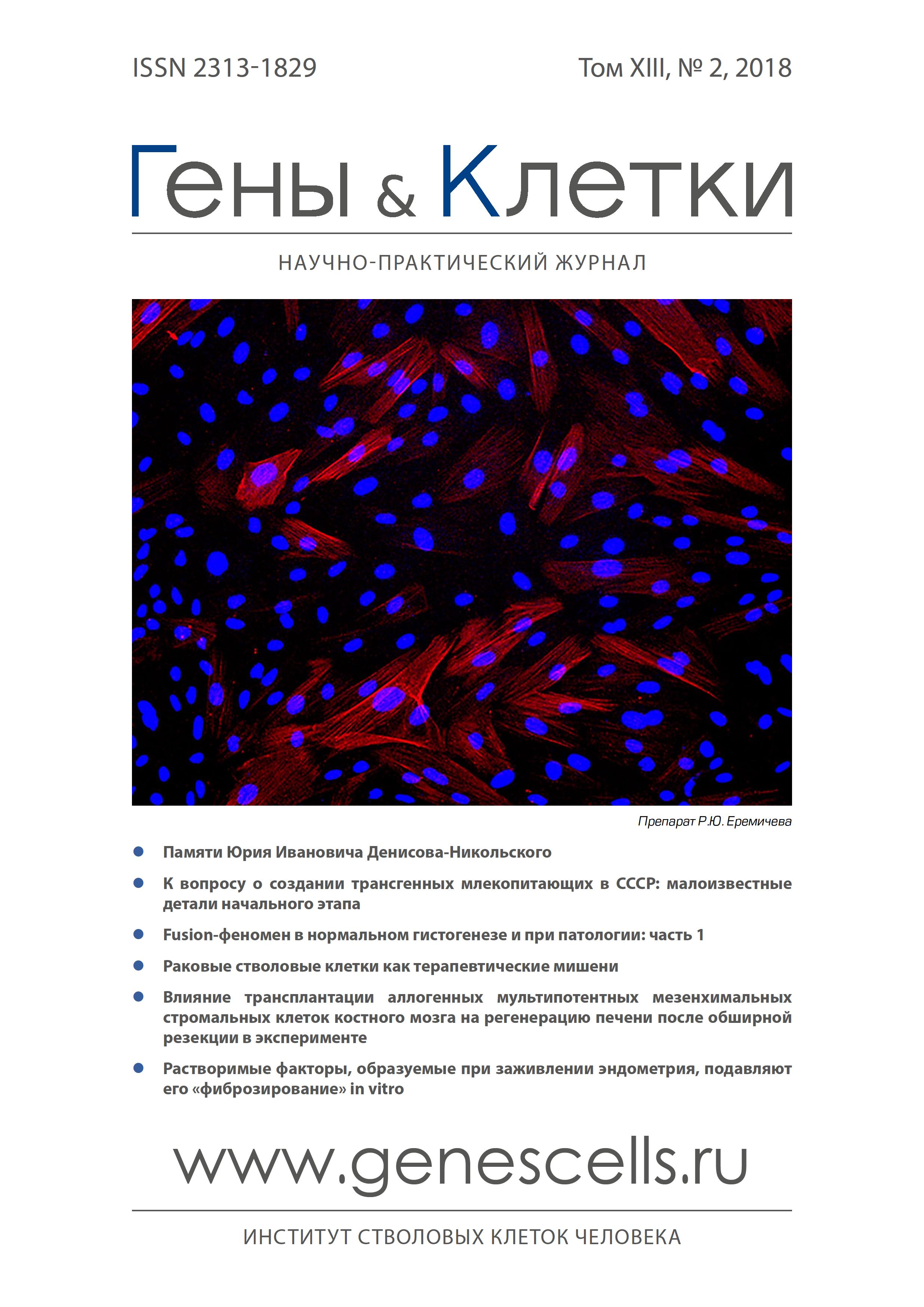
Во время каждой менструации слизистая оболочка матки женщин репродуктивного возраста заживает без фиброзирования. Ранее мы показали, что выделяющиеся при этом растворимые факторы оказывают противофиброзное действие на культуру мезенхимных стромальных клеток эндометрия человека. Задачей данной работы являлась оценка противофиброзных свойств этих факторов на модели фиброза эндометрия in vitro. От здорового донора в один день были получены сыворотки менструальной и периферической крови. Из менструальной крови также были выделены мезенхимные стромальные клетки эндометрия. Моделирование фиброза эндометрия in vitro проводилось путем трансдифференцировки мезенхимальных стромальных клеток эндометрия в миофибробласты под действием TGF-ß1 (5 нг/мл). Оценку эффективности противофиброзного действия сыворотки менструальной крови на мезенхимальные стромальные клетки эндометрия и полученные из них миофибробласты осуществляли путем подсчета нормированной на количество ядер общей площади флуоресцентного сигнала, отраженного на изображениях культуры мезенхимных стромальных клеток эндометрия, полученных при детекции а-гладкомышечного актина методом иммуноцитофлуоресценции. В качестве контроля использовали сыворотку периферической крови с равной концентрацией белка. Мы показали, что сыворотка менструальной крови уменьшает количество стресс-фибрилл, позитивных на а-гладкомышечный актин (маркер миофибробластов), как в культуре мезенхимальных стромальных клеток эндометрия, так и при in vitro моделировании фиброза эндометрия с применением TGF-ß1. Полученные нами результаты свидетельствуют о содержании в сыворотке менструальной крови растворимых факторов, обладающих противофиброзными свойствами. Возможно, их идентификация позволит объяснить механизмы заживления эндометрия, не сопровождаемого фиброзированием, а также выявить причины фиброза слизистой оболочки матки при гинекологических заболеваниях и разработать эффективные методы их лечения.
Ключевые слова
Полный текст
Об авторах
Р. Ю Еремичев
Институт регенеративной медицины, Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова
О. А Григорьева
Институт регенеративной медицины, Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова
К. Ю Кулебякин
Институт регенеративной медицины, Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова
А. Ю Ефименко
Институт регенеративной медицины, Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова
П. И Макаревич
Институт регенеративной медицины, Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова
Email: pavel.makarevich@gmail.com
Список литературы
- R., Hart R., Karthigasu K.A. et al. A re-appraisal of the morphological changes within the endometrium during menstruation: A hysteroscopic, histological and scanning electron microscopic study. Hum Reprod. 2009; 24(6): 1393-401.
- Zhou Q., Wu X., Dai X. et al. The different dosages of estrogen affect endometrial fibrosis and receptivity, but not sdf-1/cxcr4 axis in the treatment of intrauterine adhesions. Gynecol Endocrinol. 2018; 34(1): 49-55.
- Zhu H.Y., Ge T.X., Pan Y.B. et al. Advanced role of hippo signaling in endometrial fibrosis: Implications for intrauterine adhesion. Chin Med J (Engl). 2017; 130(22): 2732-7.
- Shen M., Liu X., Zhang H. et al. Transforming growth factor beta1 signaling coincides with epithelial-mesenchymal transition and fibroblast-tomyofibroblast transdifferentiation in the development of adenomyosis in mice. Hum Reprod. 2016; 31(2): 355-69.
- Ibrahim M.G., Sillem M., Plendl J. et al. Myofibroblasts are evidence of chronic tissue microtrauma at the endometrial-myometrial junctional zone in uteri with adenomyosis. Reprod Sci. 2017; 24(10): 1410-1418.
- Li J., Du S., Sheng X. et al. Microrna-29b inhibits endometrial fibrosis by regulating the sp1-tgf-beta1/smad-ctgf axis in a rat model. Reprod Sci. 2016; 23(3): 386-94.
- Li J., Cen B., Chen S. et al. Microrna-29b inhibits tgf-beta1-induced fibrosis via regulation of the tgf-beta1/smad pathway in primary human endometrial stromal cells. Mol Med Rep. 2016; 13(5): 4229-37.
- Falke L.L., Gholizadeh S., Goldschmeding R. et al. Diverse origins of the myofibroblast-implications for kidney fibrosis. Nat Rev Nephrol. 2015; 11(4): 233-44.
- Pellicoro A., Ramachandran P., Iredale J.P. et al. Liver fibrosis and repair: Immune regulation of wound healing in a solid organ. Nat Rev Immunol. 2014; 14(3): 181-94.
- Kong P., Christia P.,Frangogiannis N.G. The pathogenesis of cardiac fibrosis. Cell Mol Life Sci. 2014; 71(4): 549-74.
- Wynn T.A.,Ramalingam T.R. Mechanisms of fibrosis: Therapeutic translation for fibrotic disease. Nat Med. 2012; 18(7): 1028-40.
- Еремичев Р.Ю. М.О.А., Александрушкина Н.А., Кулебякин К.Ю., Дыйканов Д.Т., Макаревич П.И. Сыворотка менструальной крови оказывает противофиброзное действие на мезенхимные стромальные клетки эндометрия человека. Цитология 2018; 60(2): 96-103.
- Ferguson M.W.,O'Kane S. Scar-free healing: From embryonic mechanisms to adult therapeutic intervention. Philos Trans R Soc Lond B Biol Sci. 2004; 359(1445): 839-50.
- Chen C.Z., Peng Y.X., Wang Z.B. et al. The scar-in-a-jar: Studying potential antifibrotic compounds from the epigenetic to extracellular level in a single well. Br J Pharmacol. 2009; 158(5): 1196-209.
- Talele N.P., Fradette J., Davies J.E. et al. Expression of alpha-smooth muscle actin determines the fate of mesenchymal stromal cells. Stem Cell Reports. 2015; 4(6): 1016-30.
- Anders H.J.,Schaefer L. Beyond tissue injury-damage-associated molecular patterns, toll-like receptors, and inflammasomes also drive regeneration and fibrosis. J Am Soc Nephrol. 2014; 25(7): 1387-400.
- Desai V.D., Hsia H.C.,Schwarzbauer J.E. Reversible modulation of myofibroblast differentiation in adipose-derived mesenchymal stem cells. PLoS One. 2014; 9(1): e86865.
- Yang X., Chen B., Liu T. et al. Reversal of myofibroblast differentiation: A review. Eur J Pharmacol. 2014; 734: 83-90.
Дополнительные файлы