Effects of xenotransplantation of neural stem progenitor cells isolated from «olfactory epithelium» on the functional activity of the retina after ischemia modeled
- Authors: Chentsova E.V.1, Kuprashvili I.T.1, Zueva M.V.1, Tsapenko I.V.1, Saburina I.N.2, Repin V.S.2, Revishchin A.V.3
-
Affiliations:
- Helmholtz Research Institute of Eye Diseases, Rosmedtechnologies
- Biomed Ltd
- Institute of Gene Biology, RAS
- Issue: Vol 2, No 4 (2007)
- Pages: 47-51
- Section: Original Study Articles
- URL: https://genescells.ru/2313-1829/article/view/134119
- DOI: https://doi.org/10.23868/gc134119
- ID: 134119
Cite item
Full Text
Abstract
Neural stem/ progenitor cells [NSPCs] isolated from the olfactory area of human nasal mucosa are considered as one of the most promising sources for autologous material in cellular therapy and tissue engineering.
Xenotransplantation of NSPCs was performed in rabbits with ischemia retinae caused by laser coagulation of retina vessels of the l-II class. The cells were introduced into suprachoroldal space. Electroretinographic studies were done to evaluate the extent and degree of functional activity changes of the retina and functional reparative effects of transplantation.
According to electroretinography single transplantation of NSPCs promotes the maintenance and recovery of the retinal function in modelled acute ischemia retinae that correlates with the results of ophthalmoscopy done.
Transplantation of neural stem progenitor cells into suprachoroldal space has been shown to be a safe and effective method of introduction of cells in order to treat retinal disorders due to ischemia.
Full Text
Введение
Травма органа зрения занимает одно из ведущих мест среди причин инвалидности по зрению. При этом более половины случаев потери зрения связано с травматической патологией глазного дна, такой как отек и ишемия сетчатки, разрывы и отрывы сетчатки от зубчатой линии, отслоение сетчатки, токсические и посттравматические дистрофические изменения сетчатки. Несмотря на использование современных хирургических и медикаментозных методов лечения, возвращения утраченных функций сетчатки достигнуть не удается.
До 80-х годов XX века торможение восстановительных процессов в нервной ткани при травме связывали с глиальным рубцом, который препятствует прорастанию аксонов. Позднее, с совершенствованием техники исследования в данной области, блокирование регенеративных процессов стали объяснять ранним развитием в зоне травмы дисбаланса тканевых пептидов — дефицитом белковых ростстимулирующих нейротрофических факторов и опережающим появлением белков — ингибиторов роста [1-3].
В начальный период — от момента травмы до первых суток — вслед за механическим первичным повреждением ткани сетчатки уже через несколько минут начинается этап вторичного метаболического повреждения. Здесь играют роль механизмы ишемического повреждения вследствие нарушения кровообращения, спазма и нарушения проницаемости капилляров вокруг очага первичной травмы с последующим вазогенным и позднее цитотоксическим отеком ткани сетчатки.
Высвобождение метаболитов арахидоновой кислоты, простагландинов, а также нейтрофильная инфильтрация, сопровождающаяся выбросом в ткань миелопероксидазы и эластазы, расширяют ареал повреждения с формированием в соседних с первичной травмой участках сетчатки новых очагов некроза. Позднее зона некроза очищается макрофагами и нейтрофилами. В прилегающей к месту травмы сетчатке продолжается гибель отдельных нейронов за счет апоптоза. Завершающим этапом является организация дефекта путём формирования глиального рубца за счет гиперплазии микроглии и астроцитов.
В конце XX века стали появляться предположения о возможности восстановления структурной целостности сетчатки с помощью клеточных технологий. Одним из наиболее перспективных видов клеточного материала для трансплантации с целью лечения заболеваний сетчатки являются нейральные стволовые/прогениторные клетки [НСПК], выделенные из обонятельной области слизистой оболочки носа взрослого человека.
НСПК из обонятельной области слизистой оболочки носа человека впервые выделили в 2ОО1году. Отдельную субпопуляцию в обонятельной части слизистой оболочки носа человека образуют так называемые обкладочные нейроэпителиальные клетки, обладающие свойствами нейральных стволовых клеток. «Обонятельный эпителий» и гломерулярный слой обонятельных луковиц млекопитающих содержат специализированные глиальные клетки, обладающие способностью стимулировать аксональную регенерацию нейронов центральной и периферической нервной системы [4-6]. В англоязычной литературе эти клетки получили название «olfactory ensheathing cells» [OECs], «обкладочные» [«оболочечные»] клетки «обонятельного эпителия». В отечественной гистологической терминологии аналога этому понятию не существует. Известно, что OECs выделяют различные нейротрофические факторы: фактор роста нервов [NGF] [7], нейротрофический фактор, синтезируемый в головном мозге [BDNF] [8] и реснитчатый нейротрофический фактор [9]. Эти факторы, также как внеклеточные матричные молекулы [10] могут играть значительную роль в регенерации сетчатки после повреждения. Имеются также сведения, что клетки базального слоя «обонятельного эпителия» мыши могут дифференцироваться и в экстранейрональном направлении.
Учитывая значительную роль электроретинографии в дифференциальной и топической диагностике тонких изменений функциональной ретинальной активности, целью настоящего исследования явилось изучение влияния ксенотрансплантации нейральных стволовых/прогениторных клеток из обонятельной области слизистой оболочки носа человека на сохранность и динамику восстановления биоэлектрической активности сетчатки кролика при моделировании ретинальной ишемии.
Материал и методы
Исследования проводились на 15 кроликах [30 глаз] породы Шиншилла весом 2.5-3.0 кг. С целью создания острой ишемии сетчатки выполняли транспупиллярную лазер- коагуляцию ретинальных сосудов І-Il порядка. Процедура выполнялась с помощью аргоновой лазерной установки Visulas Argon II [Karl Zeiss, Германия] под местной анестезией [1% раствор дикаина] и под контролем фундус линзы [лазеркоагуляцию производил д.м.н. Иванов А.Н.] Средняя мощность излучения составляла 600-800 мВт, длительность экспозиции — 0,1с, диаметр пятна — 300 мкм, количество коагулятов — 100. Проводилась коагуляция видимых сосудов на всем их протяжении, на 1/2 РД от диска зрительного нерва. На следующий день после лазеркоагуляции в супрахориоидальное пространство глаз опытной группы животных вводили 500 тыс. НСПК в 0,02 мл сбалансированного физиологического раствора [СФР], в контрольной группе вводили 0,02 мл СФР.
НСПК выделяли из обонятельной области слизистой оболочки носа человека по стандартной методике. Диссоциированные клетки рассевали в чашки Петри в концентрации 100-200 тыс. клеток в 1 мл ростовой среды DMEM/F12, содержащей фактор роста фибробластов, эпидермальный фактор роста, гепарин, І/ITC [инсулин, трансферрин, селенит] и 3-5% эмбриональной телячьей сывороткиё. Культивировали до монослоя. Первичные культуры пересевали через ID15 сут. Пассированные культуры НСПК представляли собой активно пролиферирующие прикрепленные колонии мелких эпителиальных клеток, в которых содержание нестин/виментин положительных клеток составляло не менее 60%. Другие клетки экспрессировали GFAP и ß-тубулин. При переводе культур на бессывороточную среду наблюдалось образование характерных нейросфер, которые продолжали пролиферировать в суспензионной культуре. Для трансплантаций использовали клетки после 6-8 пассажей.
Клиническое наблюдение осуществлялось с помощью биомикроскопии, офтальмоскопии и фоторегистрации.
Всем кроликам выполняли регистрацию электроретинограммы [ЭРГ] при расширении зрачка 1% раствором мидриацила и анестезии роговицы 0,5% раствором дикаина. Исследования проведены с помощью диагностической электрофизиологической мини-системы «Mjolner» [Ephios АВ, Швеция]. Интенсивность вспышек составляла 1,7 кдхс/м2. С помощью активного электрода - контактной линзы «ERG Jet» с кольцевым золотым напылением — регистрировали ЭРГ на одиночные стимулы света и на мелькания частотой 30 Гц [ритмическая ЭРГ - РЭРГ]. Игольчатые электроды [референтный и земляной] располагались подкожно в области лба кроликов. Исследования проводили после предварительной 20-минутной темновой адаптации до и через 1 сут. после лазерной фотокоагуляции сосудов [через 15 минут после введения НСПК и СФР], а также через 7, 14 и 30 дней после моделирования ишемии сетчатки.
Результаты и обсуждение
При биомикроскопии как в контроле, так и в опыте отмечались умеренная гиперемия и отек конъюнктивы преимущественно в зоне вмешательства, постепенно проходящие на 5-й день после трансплантации. За время наблюдения со стороны переднего отрезка воспалительных явлений не наблюдалось. Оптические среды глаза сохраняли прозрачность. При офтальмоскопии после лазеркоагуляции отмечалось сужение всех сосудов с полной или почти полной остановкой кровотока, сохраняющееся на протяжение 2-5 минут, после чего кровоток несколько восстанавливался, но сосуды оставались резко сужеными.
На следующий день после коагуляции на глазном дне у некоторых кроликов наблюдалась незначительная гиперемия, стушеванность границ диска зрительного нерва из-за отека окружающей сетчатки, сужение артерий с полным прекращением кровотока в некоторых из них. Отмечались ампулообразное расширение вен, застои, отек сетчатки походу сосудов [рис. 1 А]. На периферии патологические изменения не выявлены.
За последующие 7 суток кровоток в сосудах сетчатки постепенно улучшался. Сохранялся неравномерный калибр артерий с участками их полной окклюзии [рис. 1 Б]. В венах увеличился застой, они становились более широкими, появилась патологическая извитость. Сетчатка по ходу сосудов стала менее отечная. В местах лазеркоагуляции походу сосудистого пучка появились дистрофические хориоретинальные очаги разной величины. На периферии также обнаруживались участки очагового некроза сетчатки.
Рис. 1. Глазное дно кролика: А — через сутки; Б — через 7 дней после лазеркоагуляции сосудов сетчатки
На более поздних сроках наблюдения [14-20 дней] отмечалось медленное восстановление кровотока в ретинальных сосудах, развитие коллатералей. Просвет сосудов становился более равномерным на всем протяжении, но восстановления их калибра до исходного уровня не отмечалось. В венах сохранялись застойные явления, на сетчатке — прежние дистрофические очаги. В опытной группе при офтальмоскопии выявлялось меньшее количество дистрофических очагов сетчатки, чем в контрольной группе [рис. 2 А, Б], однако провести количественное их сравнение не представлялось возможным из-за вариабельности размеров и форм очагов.
Рис. 2. Глазное дно кролика с дистрофическими очагами: А — контроль; Б — опыт.
При электроретинографии через сутки после лазерной коагуляции сосудов сетчатки [I - III порядка] на глазах у животных как в опытной группе, так и в контрольной отмечалась гиперреакция сетчатки. В среднем по группе амплитуда a-волны ЭРГ [корнео-негативного потенциала, источником генерации которого являются фоторецепторные клетки] через сутки составляла 133% и 129% от исходных значений для глаз опытной и контрольной групп животных соответственно. Гиперреакция сетчатки в первые сутки после лазеркоагуляции вызвана раздражением фоторецепторов в ответ на острую ишемию.
Корнео-позитивный компонент ЭРГ — волна-b, которая генерируется клеточными элементами внутреннего ядерного слоя сетчатки [при доминирующем вкладе ON-биполярных клеток, а также глиальных клеток Мюллера], через сутки после лазеркоагуляции практически не отличалась от исходных значений в контроле [в среднем, 96%], но в глазах с НСПК она резко возрастала [до 138%].
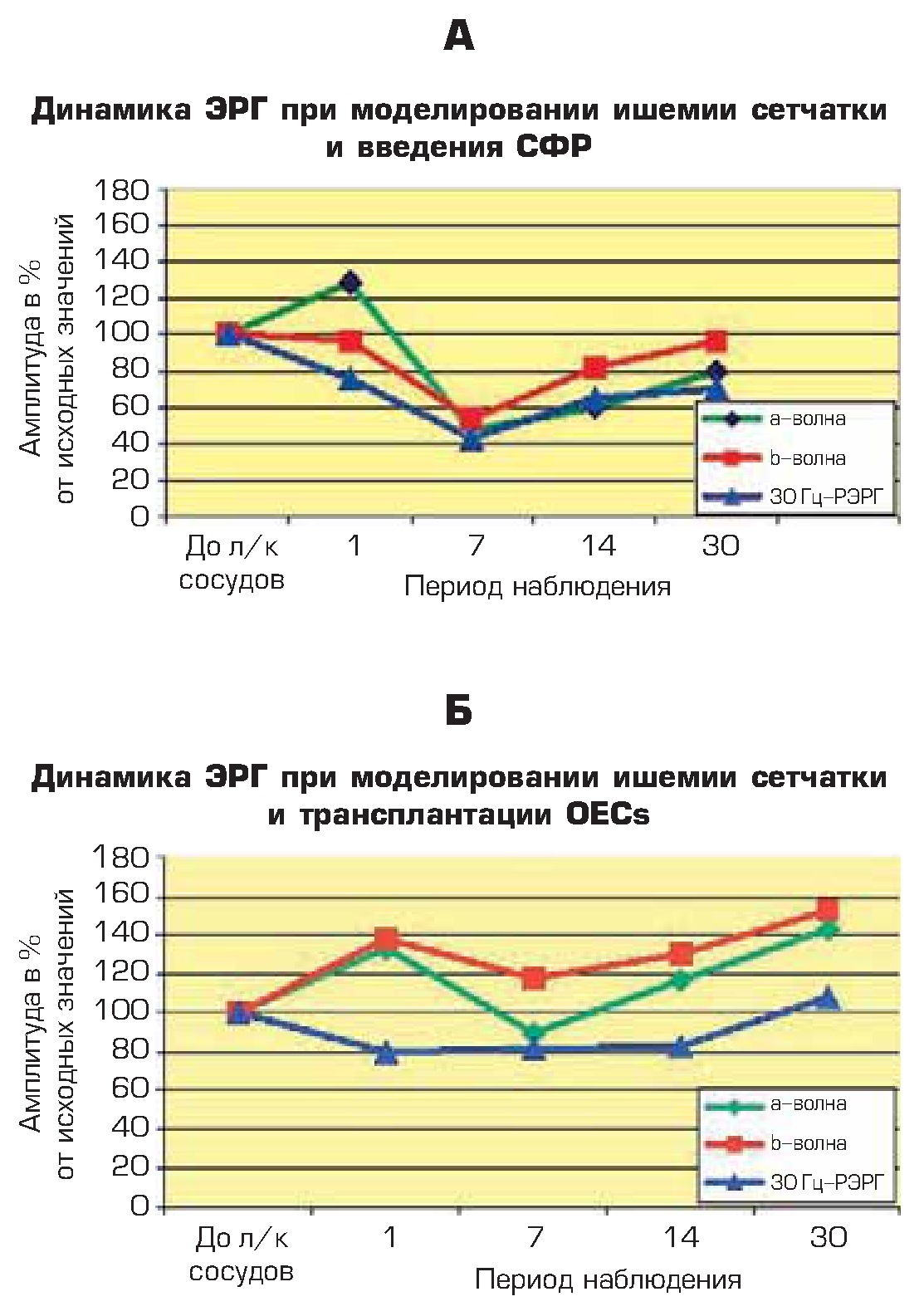
Через 1 неделю после моделирования ретинальной ишемии амплитуды всех биопотенциалов в контрольной группе достоверно снижались, причем наибольшему угнетению подвергалась а-волна ЭРГ. В глазах контрольной группы животных амплитуды а- и b-волн ЭРГ и РЭРГ с частотой 30 Гц составляли в среднем 47, 53 и 43% от индивидуальной нормы. В течение последующих 2-х недель при введении СФР на фоне ретинальной ишемии происходило медленное восстановление биоэлектрической активности сетчатки, что соответствовало наблюдаемой при офтальмоскопическом обследовании тенденции к нормализации кровотока. Однако неравномерный калибр сосудов, сохранение застойных явлений в ретинальных венах и наличие дистрофических очагов коррелировало с динамикой ЭРГ, и даже в конце периода наблюдения амплитуды а-, b-волн ЭРГ и РЭРГ в глазах контрольной группы животных составляли только ВО, 96 и 70% соответственно (рис. 3 А).
В глазах животных опытной группы после моделирования ретинальной ишемии и введения НСПК через 7 дней у 2/3 животных амплитуды а- и b-волн ЭРГ резко превышали свои исходные значения, а у 1/3 — оставались в пределах нормальных или умеренно сниженных значений. В среднем, значения а-, b-волн ЭРГ и РЭРГ через неделю достигали 90,118 и 82% от индивидуальной исходной нормы. Через 14 дней амплитуды волн ЭРГ в глазах животных опытной группы умеренно превышали норму, и выраженная гиперреакция сетчатки сохранялась до конца срока наблюдения. Наиболее резко возрастала b-волна ЭРГ, значения которой достигали 153%, что может отражать активизацию глиальных клеток Мюллера, возможно компенсаторно-приспособительного характера. Через месяц наблюдения средняя по группе амплитуда а- и b-волн ЭРГ составляла 133 и 140% от нормы. Амплитуда РЭРГ соответствовала нормальным значениям и составляла в среднем 108% от исходных величин (рис. 3 Б).
Рис. 3. Динамика ЭРГ и РЭРГ при супрахориоидальном введении СФР (А) и НСПК (Б) на фоне ишемии сетчатки.
По оси абсцисс — период наблюдения (сут.);
по оси ординат — амплитуда биопотенциалов (%)
Следует отметить, что при моделировании ретинальной ишемии в отдаленные сроки наблюдения в глазах животных опытной группы и контрольной ритмическая ЭРГ на 30 Гц практически всегда имела субнормальные значения при минимальной амплитуде через 7 суток после лазеркоагуляции. Изменения РЭРГ на мелькающий стимул были статистически достоверными но менее выраженными, чем начальные альтерации волн ЭРГ на одиночные вспышки. Биопотенциалы сетчатки на высокочастотные мелькания имеют чисто нейральную [в большей степени фоторецепторную] природу генерации. Учитывая также данные литературы о селективной чувствительности РЭРГ с частотой 3040 Гц к развитию в сетчатке человека изменений дистрофического характера, угнетение ритмических ответов, по-видимому, следует рассматривать как отражение очагов органических нарушений, что подтверждали данные наших офтальмоскопических наблюдений.
На фоне лечения НСПК через месяц амплитуда РЭРГ в глазах животных опытной группы соответствовала нормальным значениям [108% от исходных величин], в то время как в глазах животных контрольной группы на поздних сроках эксперимента она оставалась сниженной на 30% (таб.).
Величина показателей ЭРГ и РЭРГ в контрольной и опытной группах
Срок (сут.) | Параметры | Величина параметра в опытной группе, % | Величина параметра в контрольной группе, % |
1 | a-волны ЭРГ | 133 | 129 |
b-волна ЭРГ | 138 | 96 | |
7 | а-волна ЭРГ | 90 | 47 |
b-волна ЭРГ | 118 | 53 | |
РЭРГ | 82 | 43 | |
30 | а-волна ЭРГ | 133 | 80 |
b-волна ЭРГ | 140 | 96 | |
РЭРГ | 108 | 70 |
Заключение
По данным ЭРГ трансплантация НСПК на фоне ишемии обладает нейропротекторным действием, что выражается в больших величинах ЭРГ и РЭРГ в опытной группе.
В ранние сроки после лазерного воздействия трансплантация НСПК способствовала сохранению ретинальной функции и снижению выраженности ишемических и дистрофических изменений на глазном дне.
В более поздние сроки, когда происходило частичное восстановление кровообращения сетчатки, эффект НСПК в опытной группе проявлялся в лучшей динамике восстановления ретинального электрогенеза по сравнению с контролем.
Таким образом, супрахориоидальная трансплантация НСПК проявила себя безопасным и эффективным способом введения клеток с целью лечения заболеваний сетчатки в эксперименте на кроликах.
About the authors
E. V. Chentsova
Helmholtz Research Institute of Eye Diseases, Rosmedtechnologies
Author for correspondence.
Email: info@eco-vector.com
Russian Federation, Moscow
I. T. Kuprashvili
Helmholtz Research Institute of Eye Diseases, Rosmedtechnologies
Email: info@eco-vector.com
Russian Federation, Moscow
M. V. Zueva
Helmholtz Research Institute of Eye Diseases, Rosmedtechnologies
Email: info@eco-vector.com
Russian Federation, Moscow
I. V. Tsapenko
Helmholtz Research Institute of Eye Diseases, Rosmedtechnologies
Email: info@eco-vector.com
Russian Federation, Moscow
I. N. Saburina
Biomed Ltd
Email: info@eco-vector.com
Russian Federation, Moscow
V. S. Repin
Biomed Ltd
Email: info@eco-vector.com
Russian Federation, Moscow
A. V. Revishchin
Institute of Gene Biology, RAS
Email: info@eco-vector.com
Russian Federation, Moscow
References
- Savio T., Schwab М.Е. Rat CNS white matter, but not gray matter, is nonpermissive for neuronal cell adhesion and fiber outgrowth. J. Neurosci. 1989; 4: 1126-33.
- Schwab M.E. Structural plasticity of the adult CNS. Negative control by neurite growth inhibitory signals. Int. J. Dev. Neurosci. 1996; 4: 379-85.
- Savaskan N.E., Plaschke M., Ninnemann O. et al. Myelin does not influence the choice bechaviour of entorhinal axons but strongly inhibits their outgrowth length in vitro. Eur. J. Neurosci. 1999; 1:316-26.
- Little C.W., Cox C., Wyatt J. et al. Correlates of photoreceptor rescue by transplantation of human fetal RPE in RCS rat. Exp. Neurol. 1998; 1:155-60.
- Roisen F.J., Klueber K.M., Lu C.L. et al. Human adult olfactory stem cells. Brain Res. 2001; 890:11-22.
- Barnett S. C., Riddell J. S. Olfactory ensheathing cells [OECs) and the treatment of CNS injury: advantages and possible caveats. J. Anat. 2004; 204:57-67.
- Bandtlow C.E., Heumann R., Schwab M.E., Thoenen H. Cellular localization of nerve growth factor synthesis by in situ hybridization. EMBO J. 1987; 6:891-899.
- Acheson A., Barker P.A., Alderson R.F. et al. Detection of brain-derived neurotrophic factor-like activity in fibroblasts and Schwann cells: inhibition by antibodies to NGF. Neurol. 1991; 7:265-75.
- Friedman B., Scherer S.S. Rudge J.S. et al. Regulation of ciliary neurotrophic factor expression in myelin-related Schwann cells in vivo. Neurol. 1992; 9:295-305.
- Bunge R.P., Bunge M.B., Eldridge C.F. Linkage between axonal ensheathment and basal lamina production by Schwann cells. Ann. Rev. Neurosci. 1986; 9:305-28.
Supplementary files